Equivalente-grama de uma substância é a massa dessa substância que corresponde a 8 gramas de oxigênio.
Richter e as massas equivalentes
O gás metano encontra-se na natureza e é constituído por hidrogênio e carbono. Constata-se, experimentalmente, que 1g de hidrogênio precisa combinar-se com 3g de carbono para formar o gás metano. Inversamente, decompondo-se 4g do gás, 3g são de carbono e 1g de hidrogênio. Sabe-se, também, que a água é constituída de hidrogênio e oxigênio, na proporção de 1g para 8g, respectivamente.
Do que foi dito, percebe-se que uma massa fixa de hidrogênio (1g) reage com as massas de carbono (3g) e de oxigênio (8g), resultando, em cada caso, compostos diferentes (metano e água).
Tomemos, agora, um composto formado por carbono e oxigênio (elementos que se combinam com a massa fixa de hidrogênio) e determinemos a proporção entre as massas desses elementos.
1g de hidrogênio + 3g de carbono = 4g de metano
1g de hidrogênio + 8g de oxigênio = 9g de água
3g de carbono + 8g de oxigênio = 11g de dióxido de carbono
Tentando obter uma resposta, suponhamos outra substância, ainda constituída de carbono e oxigênio, por exemplo, o monóxido de carbono. Constataremos que a proporção, agora, é de 3g de carbono para cada 4g de oxigênio.
Verificamos que a proporção mudou, mas percebemos que 4g é submúltiplo de 8g. Será isso mesmo? Provavelmente você estará sugerindo novas experiências.
Partamos, novamente, de duas substâncias formadas por um elemento comum, por exemplo, o metano (1g de hidrogênio : 3g de carbono) e o cloreto de hidrogênio (1g de hidrogênio : 35,5g de cloro). Tomemos, agora, um composto formado por carbono e cloro (elementos não-comuns) e determinemos a proporção em que esses elementos estão combinados. Uma substância que preenche essas características é o tetracloreto de carbono, na qual se constata que a proporção de combinação é de 3g de carbono : 35,5g de cloro, ou seja, as mesmas quantidades que se combinam com a massa fixa de hidrogênio.
1g de hidrogênio + 3g de carbono = 4g de metano
1g de hidrogênio + 35,5g de cloro = 36,5g de cloreto de hidrogênio
3g de carbono + 35,5g de cloro = 38,5g de tetracloreto de carbono
Quando uma massa fixa m, de um elemento químico A, combina-se com as massas m1, m2, m3,…, dos elementos químicos B, C, D,…, respectivamente, se os elementos B, C, D,…, reagirem entre si, fá-lo-ão segundo as massas m1, m2, m3,…, ou segundo múltiplos ou submúltiplos delas.
Com o tempo, percebeu-se a conveniência de se fixar uma massa-padrão de equivalentes. Para isso foi escolhido a massa de 8g de oxigênio, surgindo, então, o conceito de equivalente-grama, que é usado até hoje:
Por outro lado, como 8g de oxigênio reagem totalmente com 1g de hidrogênio para formar água, podemos definir o equivalente-grama também em relação ao hidrogênio:
Equivalente-grama de uma substância é a massa dessa substância capaz de reagir com 1g de hidrogênio.
Equivalente-grama de elemento
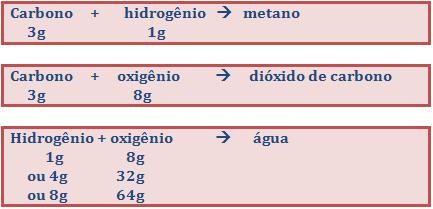 As massas 1g de hidrogênio e 8g de oxigênio apresentam o mesmo poder de combinação, ou seja, ambas combinam com 3g de carbono. Portanto, dizemos que são massas equivalentes.
As massas 1g de hidrogênio e 8g de oxigênio apresentam o mesmo poder de combinação, ou seja, ambas combinam com 3g de carbono. Portanto, dizemos que são massas equivalentes.Podemos optar pelo oxigênio como padrão para determinação do equivalente-grama dos elementos.
Equivalente-grama de um elemento define-se como a massa do elemento que se desloca ou se combina com 8 gramas de oxigênio, ou seja, equivale ao oxigênio.
Portanto:

Cálculo de equivalente
• elemento químico
Exemplos:
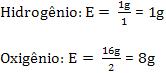
• Ácido
Exemplos:
Na reação:
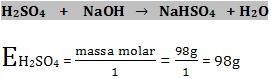
O equivalente-grama de um ácido é definido como a massa que possui ou pode fornecer 1 mol de H+ (6,02 x 1023 íons de H+).
Se ocorre a dissociação do ácido sulfúrico da seguinte forma:
Logo temos:
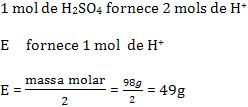
• base
Exemplo:
Na reação:

O equivalente-grama de uma base é definido como a massa que possui ou pode fornecer 1 mol de OH- (6,02 x 1023 íons OH-).
Se ocorrer a dissociação do hidróxido de magnésio da seguinte forma:
Logo temos:

É importante lembrar que: 1 equivalente-grama de ácido reage exatamente com 1 equivalente-grama de base.
• Sal
Exemplo:
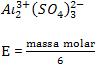
• Oxidantes e redutores

Exemplo:
Na reação não balanceada:
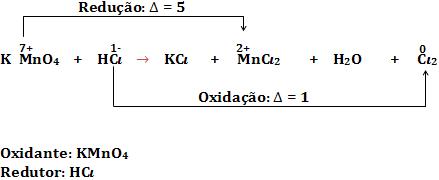
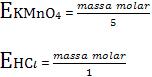
Equivalente-grama de um redutor é definida como a massa que fornece 1 mol de elétrons (6,02 x 1023 elétrons).
Equivalente-grama de um oxidante é definida como a massa que recebe um mol de elétrons (6,02 x 1023 elétrons).
Lembre-se: 1 equivalente de redutor reage exatamente com 1 equivalente de oxidante.
Numero de equivalentes A quantidade em mols que corresponde a uma massa m é dada por:
Da mesma forma, o número de equivalentes que corresponde a uma massa m é dada por:
Exemplo:
Defina o número de equivalentes que correspondem a 4,9g de H2SO4 (massa molar = 98/mol).
Resolução:
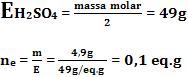
1. Conceito de dispersão
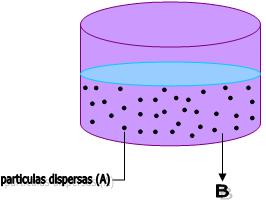
Considere a imagem abaixo, na qual uma substância A foi acrescentada a outra substância B.
A substância A será distribuída no interior da substância B, sob a forma de pequenas partículas que são chamadas de partículas dispersas.
Neste caso, denominamos a substância A como disperso e a substância B como dispergente. Portanto, dispersão é denominada como a combinação de um dispersante com um disperso.
2. Classificação das dispersões
As dispersões são classificadas em: grosseiras, colóides e soluções. A diferença entre essas dispersões está relacionada com as características das partículas dispersas.
Angstrom (Å)
1 Å = 10-8cm = 10-10m
Nanômetro (nm)
1nm = 10-9 m = 10Å
Dispersão grosseira
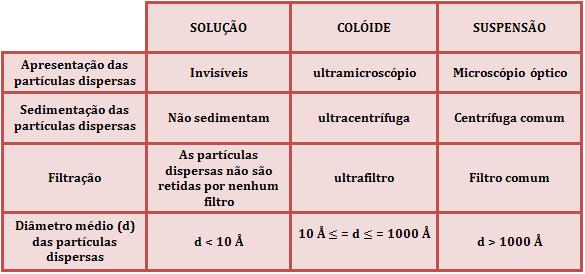
As partículas dispersas da dispersão grosseira possuem em média diâmetro superior a 1000Å (100nm), sendo assim sua visualização pode ser feita através de um microscópio ou até mesmo a olho nu. As dispersões grosseiras são subdivididas em suspensões (sólido e líquido) e emulsões (líquido e líquido).
Exemplo:
Suspensão: areia dispersa na água.
Emulsão: óleo disperso na água.
Colóide
As partículas dispersas dos colóides apresentam em média diâmetro inferior a 1000Å (100mn), sendo assim, somente através de um ultramicroscópio é que podemos fazer a sua visualização.
Exemplos:
Espuma, que é formada por bolhas de gás dispersas num líquido
Nuveme e neblina, referem-se a gotículas de água dispersas em um gás, que no caso é o ar atmoférico.
Solução
As soluções possuem as menores partículas dispersas, íons e/ou moléculas, possuindo diâmetro inferior a 10Å (1nm), não podendo, portanto, serem visualizadas por nenhum tipo de instrumento de pesquisa.
Mais adiante iremos nos aprofundar mais no estudo das soluções, que é o grupo mais importante.
Exemplos:
Açúcar dissolvido em água.
Toda mistura de gases.
NaCι dissolvido em água.
Veja mo quadro abaixo, resumidamente, as diferenças entre as três classificações das dispersões.
3. Estudo das soluções As soluções são definidas como misturas homogêneas entre um soluto (disperso, em menor quantidade) e um solvente (dispersante, em maior quantidade).
Identificação do solvente
O solvente é aquele que está em maior quantidade na solução. É o estado físico do solvente que determina o estado físico da solução.
A água é um solvente universal, portanto, toda solução que contém água, esta é considerada o solvente.
A solução quanto ao tipo de partícula
Soluções moleculares – São soluções formadas por solutos moleculares e não conduzem correntes elétricas, sendo classificadas como soluções não-eletrolíticas.
Exemplo: ar atmosférico; açúcar em água.
Soluções iônicas – Formadas por solutos que possuem carga (íons, íons fórmulas); são capazes de conduzir corrente elétrica, formando soluções eletrolíticas.
Exemplo: ácidos; bases; sais.
Observação: Apesar de os ácidos serem compostos moleculares, ionizam-se (reação química), em meio aquoso, formando íons. As soluções assim formadas são classificadas como iônicas.
4. Estudo da solubilidade
Conceito
A solubilidade é definida como a capacidade de uma substância se dissolver em outra substância.
Em relação à dissolução de sólido em líquido, podemos dizer que essa capacidade é limitada, isto é, há uma certa quantidade de soluto que podemos diluir numa certa quantidade de solvente.
Coeficiente de solubilidade ou solubilidade
Indica a quantidade máxima de uma substância que, em determinadas condições de temperatura e pressão, pode dissolver-se em quantidade fixa de solvente.
Exemplo: 7,2g de KClO3/100g de H2O/20°C.
Leitura do coeficiente: 7,2g de clorato de potássio (KClO3). É o máximo que 100g de água consegue dissolver à temperatura de 20°C. O C.S. permite outra classificação das soluções.
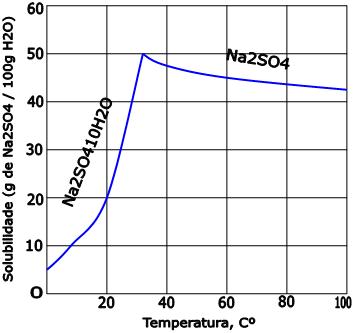
8. Curva de solubilidade de sal hidratado
A curva de solubilidade de um sal hidratado é caracterizada por um ponto de inflexão, onde há uma mudança de direção. O ponto de inflexão refere-se a uma temperatura na qual o sal hidratado perde água.
7. Tipos de dissoluções
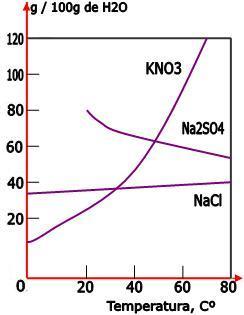
A dissolução de uma substância pode ser classificada como endotérmica ou exotérmica.
Endotérmica: a temperatura sobe facilitando a dissolução, e aumentando a solubilidade. Nesta, a curva de solubilidade é ascendente.
Exotérmica: a temperatura sobe dificultando a dissolução, e diminuindo a solubilidade. Nesta, a curva de solubilidade é descendente.
As dissoluções do KNO3 e do NaCl são endotérmicas, já a dissolução do Na2SO4 é exotérmica.
8. Curva de solubilidade de sal hidratado
A curva de solubilidade de um sal hidratado é caracterizada por um ponto de inflexão, onde há uma mudança de direção. O ponto de inflexão refere-se a uma temperatura na qual o sal hidratado perde água.

9. Solubilidade de gases em líquidos As atrações de Van der Waals entre as moléculas do gás e do líquido resulta na dissolução de um gás em um líquido. Geralmente o gás reage quimicamente com o líquido organizando novas espécies químicas. Desse modo, uma parte da amônia dissolvida reage com água.
Consideraremos a solubilidade dos gases que não apresentam reação com o líquido.
As moléculas do gás que são dissolvidas num líquido podem, imediatamente, ficarem livres do líquido. Quando a velocidade da dissolução se igualar à velocidade da liberação do líquido, dizemos que foi estabelecido um equilíbrio. Então, o líquido ficará saturado com o gás, na mesma temperatura e pressão da experiência.
Lei de Henry
“A solubilidade de um gás, em um líquido, é diretamente proporcional à pressão parcial do gás sobre o líquido.”
Considerando n como a quantidade de matérias (mols) do gás que se dissolve e P como a sua pressão acima do líquido, logo:
n = k . P
A solubilidade de gases, em água, se reduz conforme a elevação da temperatura. O aumento da temperatura, aumenta o estado de agitação das moléculas, contribuindo para que as moléculas do gás se sejam liberadas facilmente do líquido.

10. Concentrações das soluções
Dizemos que a concentração de uma solução é a relação entre a quantidade de soluto e a quantidade de solução ou de solvente. Sendo que essas quantidades podem ser representadas em: massas, volumes, número de mols, número de equivalentes.
11. Relação de massa com massa e quantidade de matéria com massa
A partir de agora iremos considerar as concentrações em que há relação entre as massas, e entre as quantidades de matéria (mols).
Vamos abordar as quatro maneiras de exprimir concentração em que há relacionamento de massa com massa ou quantidade de matéria.
A partir de agora iremos considerar as concentrações em que há relação entre as massas, e entre as quantidades de matéria (mols).
Vamos abordar as quatro maneiras de exprimir concentração em que há relacionamento de massa com massa ou quantidade de matéria.
12. Título
É a relação entre a massa do soluto e a massa da solução. É uma grandeza adimensional.

Massa da solução = massa do soluto + massa do solvente
Assim, considerando 20g de H2SO4 dissolvidos em 80g de água, o título da solução será:
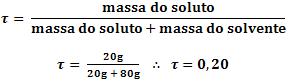
É a relação entre a massa do soluto e a massa da solução. É uma grandeza adimensional.
Massa da solução = massa do soluto + massa do solvente
Assim, considerando 20g de H2SO4 dissolvidos em 80g de água, o título da solução será:
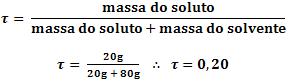
13. Porcentagem em massa Quando multiplicamos o título por 100, obtemos a porcentagem em massa:
p = % em massa = título x 100
Desse modo, a porcentagem em massa do H2SO4 na solução considerada seria: % em massa do
Assim, entendemos que, a cada 100g de solução, 20g são de H2SO4.
O título ou título em massa é comumente usado para indicar a porcentagem em massa de soluto.
14. Fração em quantidade de matéria ou fração em mols
Fração em quantidade de matéria ou fração em mols é a relação existente entre a quantidade de matéria (mols) do soluto e quantidade de matéria total da solução.

Quantidade em mols da solução = quantidade em mols do soluto + quantidade em mols do solvente
Veja o exemplo:
Considerando a mesma solução de H2SO4 com 20g de ácidos dissolvidos em 80g de água, vamos calcular a fração em mols.
Sabemos que:
massa molar do H2SO4 = 98g/mol
massa molar da água = 18g/mol

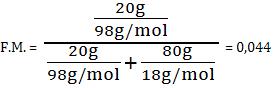
Fração em quantidade de matéria ou fração em mols é a relação existente entre a quantidade de matéria (mols) do soluto e quantidade de matéria total da solução.
Quantidade em mols da solução = quantidade em mols do soluto + quantidade em mols do solvente
Veja o exemplo:
Considerando a mesma solução de H2SO4 com 20g de ácidos dissolvidos em 80g de água, vamos calcular a fração em mols.
Sabemos que:
massa molar do H2SO4 = 98g/mol
massa molar da água = 18g/mol

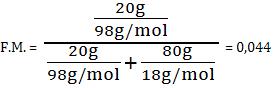
15. Concentração em mol/kg de solvente
É a relação entre a quantidade em mols do soluto e a massa do solvente em quilogramas (kg).
Simbolicamente, a concentração em mol/kg de solvente é: Mm.
Importante: a massa do solvente só pode ser representada em quilogramas.
16. Relação de massa com volume e quantidade de matéria com volume
De agora em diante, iremos abordar as concentrações expressas pelas relações entre quantidade em mols e volume e entre massa e volume.
De agora em diante, iremos abordar as concentrações expressas pelas relações entre quantidade em mols e volume e entre massa e volume.
17. Concentração comum
É a relação entre a massa do soluto e o volume da solução.
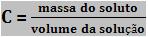
Dizemos que é um tipo de concentração comum porque o volume da solução pode ser medido com facilidade, e sabendo o valor da concentração temos, imediatamente, a massa do soluto.
Para a massa do soluto e para o volume da solução não são estabelecidas unidades obrigatórias, embora na prática, usa-se normalmente massa em gramas e volume em litros.
É a relação entre a massa do soluto e o volume da solução.
Dizemos que é um tipo de concentração comum porque o volume da solução pode ser medido com facilidade, e sabendo o valor da concentração temos, imediatamente, a massa do soluto.
Para a massa do soluto e para o volume da solução não são estabelecidas unidades obrigatórias, embora na prática, usa-se normalmente massa em gramas e volume em litros.
18. Concentração em quantidade de matéria por litro ou concentração em mol/L.
É a relação entre a quantidade em mols do soluto e o volume da solução em litros.
Simbolicamente, a concentração em mol/L é: Mv ou M.
Lembre-se: o volume da solução só deve ser representado em litros.
19. Normalidade
“É a relação entre o número de equivalentes-gramas do soluto e o volume da solução em litros.”
A normalidade é simbolizada por N.
Sabemos que, o número de equivalentes-gramas de uma substância é determinado como a relação entre a massa e o equivalente-grama dessa substância.
Simbolicamente, o número de equivalentes-gramas será: ne.
Exemplo:
Vamos determinar a normalidade da solução que contém 98g de H2SO4 dissolvidos em 1 litro da solução.
massa molar do H2SO4 = 98g/mol
Equivalente-grama do H2SO4 = 49g/eq. g

20. Partes por milhão (ppm)
Em soluções diluídas é comum utilizar a concentração em partes por milhão (ppm), que mostra o número de partes do soluto que há em 1 milhão de partes da solução.

Em soluções intensamente diluídas podemos utilizar a concentração em partes por bilhão (ppb) que mostra o número de partes do soluto que há em 1 bilhão de partes da solução.

Em soluções líquidas intensamente diluídas, a densidade da solução é praticamente igual a densidade da água.
Em soluções diluídas é comum utilizar a concentração em partes por milhão (ppm), que mostra o número de partes do soluto que há em 1 milhão de partes da solução.

Em soluções intensamente diluídas podemos utilizar a concentração em partes por bilhão (ppb) que mostra o número de partes do soluto que há em 1 bilhão de partes da solução.

Em soluções líquidas intensamente diluídas, a densidade da solução é praticamente igual a densidade da água.
21. Concentração de íons em solução Numa solução aquosa eletrolítica existem íons em solução. Considerando a concentração de uma substância, podemos calcular a concentração dos íons procedentes da dissociação iônica ou ionização da substância.
Exemplo:
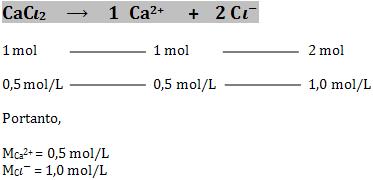
Vamos calcular a concentração em quantidade de matéria dos íons Ca2+ e Cl- numa solução 0,5 mol/L de CaCl2, estando certo de que o sal está 100% dissociado.
Resolução:
A dissociação do cloreto de cálcio ocorre da seguinte maneira:
22. Relação entre normalidade e concentração em mol/L
O equivalente-grama possui uma evidente relação com a sua massa molar.
Ademais, a concentração em mol está relacionada com a quantidade em mols, enquanto a normalidade está relacionada com o número de equivalentes-gramas. Portanto a concentração em mol está diretamente relacionada com a normalidade.
Veja a demonstração dessa relação:

Sendo assim, podemos dizer que a normalidade de uma solução é equivalente à sua concentração em mol/L multiplicada pelo número k.
O número k, para:
- os ácidos, é o número de hidrogênios ionizáveis;
- as bases, é o número de hidróxidos;
- os sais, é o total de valência dos cátions ou ânions;
- os óxidos, é o total de valência do elemento combinado com oxigênio, etc.
Exemplos:
Solução 1M de HCl
N = M . k ∴ N = 1 . 1 = 1
Uma solução 1M de HCl é também 1N
Solução 1M de H2SO4
N = M . k ∴ N = 1 . 2 = 2
Uma solução 1M de H2SO4 é também 2N
Sempre que k for um número inteiro podemos dizer que: a normalidade é sempre igual ou maior do que a concentração em mol/L, jamais será menor.
23. Outras relações
Relação entre concentração em gramas por litro e concentração em mol / L
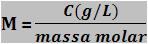
Relação entre concentração em gramas por litro e normalidade
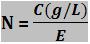
Relação entre concentração em gramas por litro e título

Relação entre concentração em mol / L e titulo
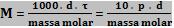
Relação entre concentração em gramas por litro e concentração em mol / L
Relação entre concentração em gramas por litro e normalidade
Relação entre concentração em gramas por litro e título

Relação entre concentração em mol / L e titulo
24. Diluição de soluções
A diluição de solução consiste na adição de um solvente a esta solução, diminuindo a sua concentração.
A massa inicial e final do soluto na diluição de soluções permanece constante, apenas volume aumenta, portanto a concentração final é menor do que a inicial.
Exemplo:
Utilizando concentração em mol/L como unidade de concentração:
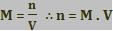
Numa solução, para conhecer a quantidade de matéria do soluto, é preciso multiplicar a sua concentração em mol/L pelo volume em litros.
Vamos considerar V1 (L) de uma solução de soluto X de concentração M1, e adicionarmos a ela V (L) de água. O volume da solução resultante será V2 (L), sendo a soma de V1 (L) e V (L), e concentração M2 que devemos determinar.
Na solução inicial, a quantidade inicial do soluto X é n1, sendo determinada por:
n1 = M1 . V1(L)
A quantidade em mols do soluto X na solução final é n2, sendo determinada por:
n2 = M2 . V2(L)
Como só foi adicionada água na solução, e a quantidade do soluto não foi alterada, logo podemos representar da seguinte forma:
n1 = n2 ∴
M1V1(L) = M2V2(L)
Quando utiliza-se a mesma quantidade de volume dos dois lados, temos:
M1V1 = M2V2
A diluição de solução consiste na adição de um solvente a esta solução, diminuindo a sua concentração.
A massa inicial e final do soluto na diluição de soluções permanece constante, apenas volume aumenta, portanto a concentração final é menor do que a inicial.
Exemplo:
Utilizando concentração em mol/L como unidade de concentração:
Numa solução, para conhecer a quantidade de matéria do soluto, é preciso multiplicar a sua concentração em mol/L pelo volume em litros.
Vamos considerar V1 (L) de uma solução de soluto X de concentração M1, e adicionarmos a ela V (L) de água. O volume da solução resultante será V2 (L), sendo a soma de V1 (L) e V (L), e concentração M2 que devemos determinar.
Na solução inicial, a quantidade inicial do soluto X é n1, sendo determinada por:
n1 = M1 . V1(L)
A quantidade em mols do soluto X na solução final é n2, sendo determinada por:
n2 = M2 . V2(L)
Como só foi adicionada água na solução, e a quantidade do soluto não foi alterada, logo podemos representar da seguinte forma:
n1 = n2 ∴
M1V1(L) = M2V2(L)
Quando utiliza-se a mesma quantidade de volume dos dois lados, temos:
M1V1 = M2V2
25. Mistura de soluções de mesmo soluto
Na mistura de soluções de mesmo soluto, sem reação química, obtemos uma nova solução que possui uma concentração intermediária às concentrações das soluções misturadas.
Exemplo:
Misturando V1 (L) de uma solução de soluto X, de concentração M1, com V2(L) de outra solução, do mesmo soluto X no mesmo solvente, de concentração M2. O volume da solução final será V3 (L), sendo a soma dos volumes misturados (V1 (L) + V2(L)) e concentração M3 que devemos determinar.
Podemos calcular em cada solução a quantidade em mols do soluto X pelo produto: M.V.
n1 = M1V1(L); n2 = M2V2(L); n3 = M3V3(L)
A relação entre as quantidades de matéria é:
n1 + n2 = n3
M1V1(L) + M2V2(L) = M3V3(L) ou
M1V1 + M2V2 = M3V3
Na mistura de soluções de mesmo soluto, sem reação química, obtemos uma nova solução que possui uma concentração intermediária às concentrações das soluções misturadas.
Exemplo:
Misturando V1 (L) de uma solução de soluto X, de concentração M1, com V2(L) de outra solução, do mesmo soluto X no mesmo solvente, de concentração M2. O volume da solução final será V3 (L), sendo a soma dos volumes misturados (V1 (L) + V2(L)) e concentração M3 que devemos determinar.
Podemos calcular em cada solução a quantidade em mols do soluto X pelo produto: M.V.
n1 = M1V1(L); n2 = M2V2(L); n3 = M3V3(L)
A relação entre as quantidades de matéria é:
n1 + n2 = n3
M1V1(L) + M2V2(L) = M3V3(L) ou
M1V1 + M2V2 = M3V3
26. Resumo geral das unidades de concentração Legendas
O solvente é representado pelo índice 1.
O soluto é representado pelo índice 2.
A solução não possui índice na sua representação.
m – é a representação da massa em gramas.
n – é a representação da quantidade em mols:
ne - é a representação do número de equivalentes:
E - é a representação de equivalente-grama
V - é a representação de volume em qualquer unidade
V(L) - é a representação de volume em litros da solução.
1. Concentração em mol / L (M)
2. Normalidade (N)
3. Concentração em gramas por litro (C ou g/L)
4. Concentração em mol/kg (Mm)
5. Título em massa (
6. Fração em mols (x ou FM)
7. Porcentagem em massa (p)
8. Relação entre normalidade e concentração em quantidade de matéria

9. Relação entre concentração em mol/L e concentração em g/L
C = M (MM2)
10. Relação entre título em massa e concentração em g/L
11. Diluição de soluções
Consiste na redução da concentração de uma solução acrescentando-se um solvente.
V1M1 = V2M2
Onde,
V1 – é o volume inicial (em mL ou L)
M1 – é a concentração inicial (em M, N, g/L)
V2 – é o volume final (em mL ou L)
M2 – é a concentração final (em M, N, g/L)
12. Mistura de soluções de mesmo soluto (não podem ocorrer reações)
V1M1 + V2M2 = V3M3
Onde,
V1 – é o volume inicial da primeira solução.
M1 – é a concentração inicial da primeira solução (em M, N, g/L)
V2 – é o volume inicial da segunda solução
M2 – é a concentração inicial da segunda solução (em M, N, g/L)
V3 – é o volume final, sendo equivalente a (V1 + V2)
M3 – é a concentração final (em M, N, g/L)
http://www.colegioweb.com.br/quimica/resumo-geral-das-unidades-de-concentracao.html

Nenhum comentário:
Postar um comentário